

Nächste Seite: Bestimmung der Sauerstoffsättigung
Aufwärts: Pulsoximetrie
Vorherige Seite: Pulsoximetrie
Inhalt
Das Lambert-Beersche Gesetz:
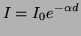 |
(6.1) |
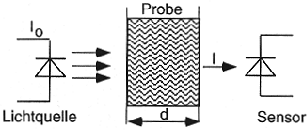
Mit d = Dicke der durchstrahlten Schicht, 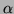 : Absorptionskoeffizient,
: Absorptionskoeffizient, 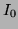 : einfallende Lichtintensität und I: austretende Lichtintensität.
: einfallende Lichtintensität und I: austretende Lichtintensität.
Abbildung 6.2:
Gesetz von Lambert-Beer
 |
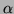 ist wellenlängenabhängig und stoffspezifisch. Besteht die Substanz aus mehreren Proben, so ergibt sich:
ist wellenlängenabhängig und stoffspezifisch. Besteht die Substanz aus mehreren Proben, so ergibt sich:
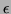 ist molarer Extinktionskoeffizient,
ist molarer Extinktionskoeffizient, 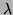 die Wellenlänge und c die Konzentration der gelösten Substanz.
die Wellenlänge und c die Konzentration der gelösten Substanz.
Abbildung:
Absorptionsspektren der Hämoglobinfraktionen
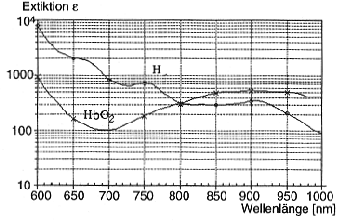 |
Ein Problem ist, dass alle Hämoglobinfraktionen optisch aktiv sind. Eine selektive Messung ist damit nicht möglich. Lösung: Wird mit verschiedenen Wellenlängen nichtinvasiv (Finger oder Ohrläppchen)durchleuchtet, so ergeben sich mehrere Gleichungen. Da sich während der Messung die Dicke d ändert, lassen sich so nur Quotienten (Sauerstoffsättigungen) bestimmen. Zur Absolutmessung muss Blut entnommen werden (Dicke von Küvette bekannt).
Michael Aschke
2000-04-14